近日,我校广东省粤北食药资源利用与保护重点实验室陈太钰教授课题组关于CO₂运输与光合作用机制的两项研究成果,相继在国际著名植物科学领域顶级期刊《New Phytologist》(中科院一区TOP,5年影响因子为10.2)和《Plant Biotechnology Journal》(中科院一区TOP,5年影响因子为12.1)收录发表。这标志着我校在植物科学领域的研究水平取得了显著提升,也为学校科研实力的增强注入了新的动力。
成果一:揭示水稻OsβCA1基因调控CO₂运输与气孔运动的新机制
1月30日,《New Phytologist》在线发表了课题组题为“Alternative Transcriptional Initiation of OsβCA1 Produces Three Distinct Subcellular Localization Isoforms Involved in Stomatal Response Regulation and Photosynthesis in Rice”的研究论文。

植物碳酸酐酶(Carbonic Anhydrase, CA)是光合作用、pH调节、气孔运动、离子平衡及碳固定等过程的关键酶,不仅催化CO2水合为HCO3-,促进其在细胞质中快速扩散,而且还通过在叶绿体基质中催化HCO3-的脱水为Rubisco提供CO2。研究团队通过对OsβCA1的cDNA全长测序数据分析,发现OsβCA1通过选择性转录产生三种亚型(OsβCA1A、OsβCA1B和OsβCA1C),分别定位于叶绿体、细胞膜和细胞质,其中,OsβCA1A/C和OsβCA1B分别约占OsβCA1总量的97%和3%。为了对不同亚型的主要生物学功能进行进一步分析,研究团队针对三个转录本分别创制CRISPR敲除突变体。进一步的生理生化实验证明:定位于叶绿体的OsβCA1A亚型通过向叶绿体基质中的Rubisco提供CO2参与到CO2的固定,而定位于细胞膜的OsβCA1B亚型则主要负责调控气孔的孔径和气孔导度。

OsβCA1基因通过选择性转录的方式产生三种不同亚细胞定位的碳酸酐酶
该研究首次揭示了水稻OsβCA1基因通过选择性转录的方式产生三种不同亚细胞定位的碳酸酐酶亚型,并阐明了这些亚型在CO2扩散、固定以及气孔运动调控中的功能分工。这一发现不仅丰富了植物CO2感知与利用的理论体系,还为提高作物CO2运输效率、优化碳固定机制以及高光效育种提供了新的研究方向。
成果二:创新Rubisco聚集策略,开辟光合作用效率提升新路径
3月14日,《Plant Biotechnology Journal》在线发表了课题组题为“Engineering Rubisco Condensation in Chloroplasts to Manipulate Plant Photosynthesis”的研究论文。

该研究创新性地提出了一种通过改造Rubisco聚集特性来提升植物光合作用效率的策略:将天然具有形成二(寡)聚体特性的接头蛋白融合至RbcL(Rubisco的大亚基)的C端。利用接头蛋白的自聚集特性以及Rubisco本身八聚体的结构特征,触发Rubisco的聚集。其中,超折叠绿色荧光蛋白(sfGFP)因其独特的二聚体和具有荧光的特性被选为理想候选蛋白。通过叶绿体转化技术,我们成功将sfGFP标记到RbcL的C端,且这一修饰既不影响Rubisco的正常表达与组装,也不改变其酶活性特征。荧光显微镜观察显示,转基因植株叶绿体中的Rubisco不再呈均质分布,而是形成了明显的聚集点。进一步的光漂白后荧光恢复(FRAP)实验证实,这些重组蛋白形成了典型的高度动态凝聚体(condensate),而非无活性的蛋白变性沉淀。
这些研究结果为后续引入羧酶体壳蛋白包裹内源Rubisco奠定了重要基础。这一突破性进展为理解Rubisco的调控机制提供了新视角,同时也为作物高光效育种和农业可持续发展提供了新的技术路径。
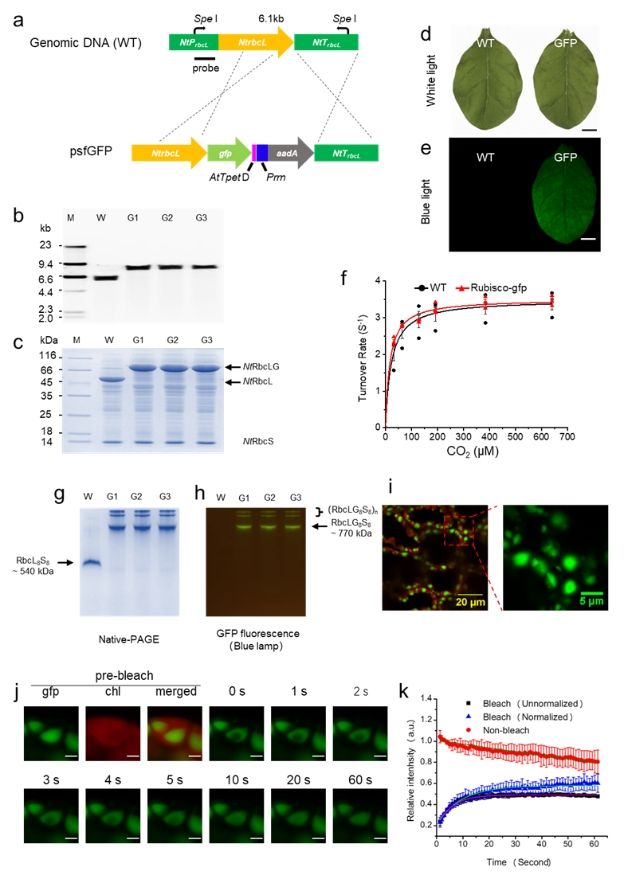
由寡聚接头触发Rubisco的高度动态凝聚体(condensate)
这两项研究成果不仅为植物光合作用机制的理论研究提供了重要突破,也为作物高光效育种和农业可持续发展提供了新的技术支撑。课题组负责人陈太钰教授表示,将继续围绕CO₂运输与固定机制开展深入研究,推动相关成果在农业生产中的应用,为实现粮食安全、应对气候变化以及促进农业绿色转型贡献智慧和力量。
学校也将以此为契机,持续加强广东省粤北食药资源利用与保护重点实验室建设,扎根粤北特色资源优势,深化与农业企业的产学研协同,为乡村振兴与区域经济社会高质量发展注入科技动能。
